15/01/2016 – 11H20 Rennes (Breizh-info.com) – L’affaire a été révélé par TF1 news : un essai pharmaceutique aurait mal tourné à Rennes, jeudi. Un patient serait en état de mort clinique et quatre autres personnes dans un état grave après avoir testé des molécules. Cet essai était réalisé, selon nos informations, pour le compte de la société rennaise Biotrial. Il s’agit en effet de la seule société privée proposant ce genre d’études rémunérées, à Rennes. La ministre de la Santé, Marisol Touraine, doit tenir une conférence de presse au CHU de Pontchaillou, à 14h30, ce vendredi.
Depuis des années, cette société recrute des volontaires, des cobayes, pour tester des médicaments notamment. « Pour pouvoir commercialiser leurs produits, les laboratoires pharmaceutiques doivent préalablement tester leurs médicaments en laboratoire, chez l’animal et in fine, organiser des essais cliniques chez l’homme. Biotrial réalise ces tests cliniques sous le contrôle d’un Comité de protection des personnes et de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) qui règlementent ces études pharmaceutiques.» indique la société.
« Votre sécurité et votre bien-être sont notre priorité »
« Votre sécurité et votre bien-être sont notre priorité », précise Biotrial sur son site. A la question « quels sont les risques d’un essai clinique ? », la société répond : « Les effets indésirables des médicaments testés sont souvent connus et nous en informons les volontaires lors d’une réunion à Biotrial, animée par l’équipe en charge de l’étude. Les essais en phase I utilisent des doses limitées. En cas de problème, le test est immédiatement arrêté. Nos équipes médicales sont présentes 24h/24 auprès des volontaires (sur site lors d’une hospitalisation ou par téléphone lors d’un essai en ambulatoire) pour une surveillance optimale. Et nous respectons bien sûr le cadre réglementaire fixé par l’ANSM.»
Cette démarche volontaire, engagée par différents types de publics, à bien entendu un intérêt lucratif pour les personnes qui s’y prêtent : « Nos études sont indemnisées de 100 à 4 500 €. Cette indemnité est non imposable et versée une fois les derniers contrôles effectués, en fin d’étude. Elle ne peut pas dépasser 4 500 € annuellement. » lit-on sur le site de la société.
La société lancée en 1989 est un centre de recherches médicales, et emploie 300 salariés dans le monde, dont 200 à Rennes et réalise 35 millions d’euros de chiffre d’affaire. « Nous intervenons entre la 4e et la 6e année de développement d’un médicament, le stade où l’on passe du cobaye animal à l’humain. » déclarait son président, Jean-Marc Gandon. En 25 années, ce sont 55 000 patients qui se sont succédés dans la clinique.
Impossible de savoir toutefois quelles seront les conséquences pour l’entreprise dans une affaire de cette ampleur ; le patient signe en effet un contrat lors de son engagement. Sur le site de la société, il est d’ailleurs bien précisé : « S’engager dans la recherche clinique vise à tester des médicaments : par définition, le risque zéro n’existe pas.». L’ANSM risque elle aussi d’être mise en cause, cette dernière jouant un rôle prépondérant dans l’autorisation de ces tests.
#Rennes > Le médicament injecté est un produit antalgique à base de cannabis, du laboratoire Biotrial (@itele)
— iTELE (@itele) 15 Janvier 2016
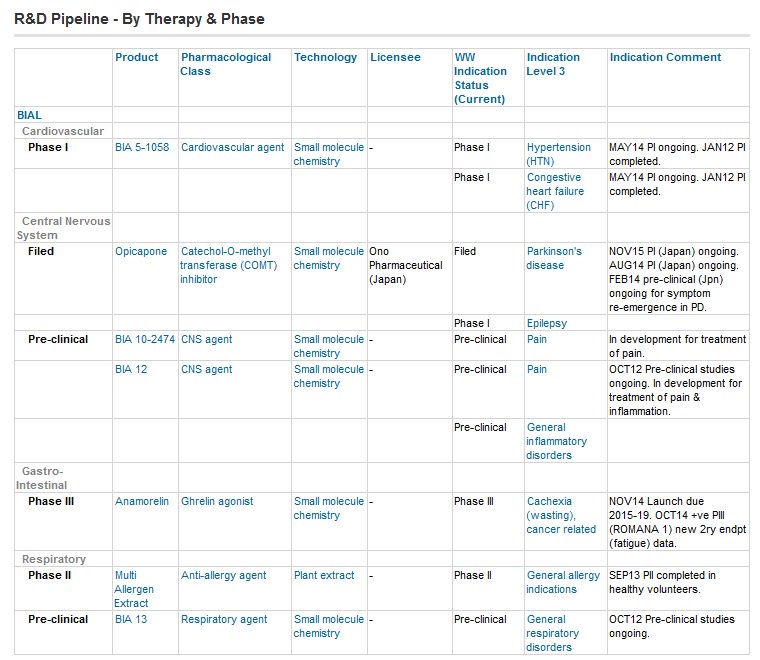
MAJ 14h : Biotrial testait une molécule du groupe pharmaceutique portugais Bial. Bial se présente comme le principal groupe pharmaceutique portugais, fondé en 1924. Ci-dessous, les différentes molécules en phase de tests concernant ce groupe . Les produits BIA 10-2474 ou BIA 12 pourraient être concernés . Problème : sur le site de l’ANSM, aucune de ces deux molécules n’apparait dans le répertoire des essais cliniques des médicaments.
Photo : DR
Breizh-info.com, 2016, dépêches libres de copie et diffusion sous réserve de mention de la source d’origine.












Une réponse à “Rennes. Un patient en état de mort clinique suite à un essai pharmaceutique réalisé par Biotrial [MAJ]”
Pour plus de précision à ce que vous écrivez : »Impossible de savoir toutefois quelles seront les conséquences pour l’entreprise dans une affaire de cette ampleur ; le patient signe en effet un contrat lors de son engagement. Sur le site de la société, il est d’ailleurs bien précisé : « S’engager dans la recherche clinique vise à tester des médicaments : par définition, le risque zéro n’existe pas.». L’ANSM risque elle aussi d’être mise en cause, cette dernière jouant un rôle prépondérant dans l’autorisation de ces tests. »
L’enquête qui est ouverte va devoir montrer quels sont les niveaux de responsabilité impactés.
Soit il s’agit d’un manquement du laboratoire pharmaceutique (BIAL) ou de la société de recherche clinique (CRO en anglais, et ici Biotrial) dans la qualité des échantillons délivrés aux patients ou un non respect des procédures médicales en rapport avec les volontaires sains (personnes chez qui l’on teste en Phase I). A priori il ne semble pas que cela soit le cas, car comme on peut l’imaginer l’administration d’un nouveau médicament chez l’homme est quelque chose de très très contrôlé et tout manquement aux règles est fatalement découverte.
Soit cela vient du médicament administré. Dans ce cas, s’agit-il d’un effet grave lié à la molécule ou s’agit il d’une réaction de l’organisme (type mauvaise réponse immunitaire du style ‘hyperréaction’ du patient comme ce que l’on peut voir dans les phénomènes allergiques). Seule l’enquête en interne permettra de le savoir.
Toutefois ce que l’on peut dire c’est que la molécule étudiée (ici un cannabinoide de synthèse) risque d’être bannie de futurs essais cliniques et que cette voie thérapeutique risque d’être compromise. Attention qui dit « canabinoïde de synthèse » ne veut pas dire que le médicament contient du cannabis. C’est une molécule qui a été développée pour se fixer aux récepteurs cannabinoïdes du cerveau. C’est d’ailleurs sur ce type de récepteur que se fixe le cannabis et depuis les années 90, on a découvert que ce type de récepteurs était impliqué dans beaucoup de maladies « neurologiques », d’où l’essai.
Pour précision un essai de Phase I, comme il semble s’agir ici, ne vise pas à connaitre l’efficacité d’une molécule chez l’homme mais à étudier son acceptation chez l’homme (sa tolérance).
C’est le premier type d’essai effectué chez l’homme après avoir réalisé des tests chez l’animal. Or il peut arriver parfois que chez les animaux la molécule administrée n’entraîne pas d’effets secondaires décelables alors qu’il peut en être tout autrement chez l’homme.